
新聞中心
News

News
 作為一種能夠進行自我更新和再生的細胞,干細胞具有修復各種組織與器官再生的潛能。干細胞療法是通過對干細胞進行分離、純化、體外擴增并定向培養后輸注到患者體內,在組織微環境的作用下,分化為新的細胞與組織,達到治療疾病的目的。
作為一種能夠進行自我更新和再生的細胞,干細胞具有修復各種組織與器官再生的潛能。干細胞療法是通過對干細胞進行分離、純化、體外擴增并定向培養后輸注到患者體內,在組織微環境的作用下,分化為新的細胞與組織,達到治療疾病的目的。干細胞治療所涉及的領域十分廣泛,如用于治療心臟病、眼病、糖尿病、腦卒中、脊髓損傷、帕金森、肌萎縮側索硬化癥、多發性硬化癥、軟骨修復、系統性紅斑狼瘡、白血病和其他血液疾病等,為廣大患者帶來了福音。間充質干細胞(MSC)是一種多能的成體干細胞,安全性高、有效性好、來源方便。目前獲批上市的干細胞藥物中,有一半以上都是間充質干細胞相關產品。目前我國干細胞臨床研究備案機構約137家,相關項目達100多個,具有廣闊的應用與市場前景。
本期小為將結合往期產品推薦系列—細胞工廠應用方向之一間充質干細胞,詳解間充質干細胞的特點、機制及功能,講述其在各類疑難雜癥上的研究與前景。
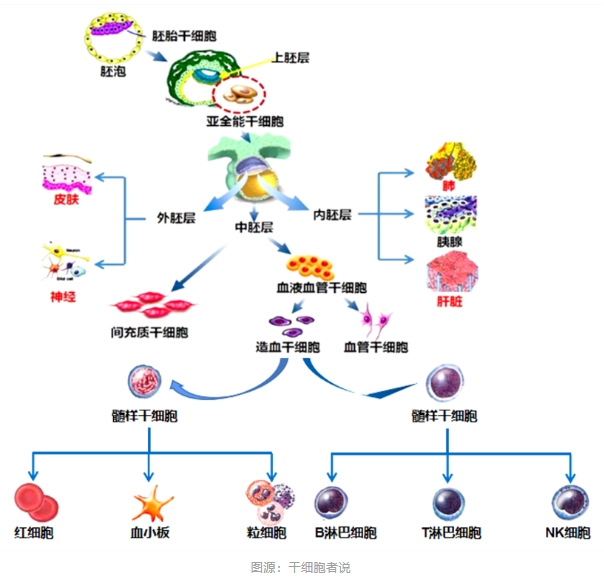
01、什么是間充質干細胞?它有何特點?
間充質干細胞是屬于中胚層的一類多能干細胞,主要存在于結締組織和器官間質中,包括:骨髓、臍帶、脂肪、粘膜、骨骼、肌肉、肺、肝、胰腺等組織以及羊水、羊膜、胎盤等,在適宜的條件下可分化為脂肪、骨、軟骨等多種組織細胞。
MSC特點:
1.自我復制:可通過自身分化作用分化成為相應組織的細胞,起到替代作用。
2.多向分化:同胚層、跨胚層分化。
3.高活性、低免疫原性:可以抑制免疫排斥反應,比如在造血干細胞移植中聯合移植間充質干細胞,可大幅降低GVHD(移植物抗宿主病)或慢性排斥反應的發生率。
4.旁分泌效應:可通過旁分泌效應分泌細胞因子,促進組織的自身修復效果。
5.歸巢效應:自帶GPS系統,找到機體“病灶”,并優先修復受損部位。
MSC應用廣泛的原因:
√ 首先,MSC避免了胚胎干細胞研究的倫理問題:來源符合美國AATB認證機構的道德標準,可確保在嚴格的GMP條件下達到95%以上的高存活率;
√ 其次,MSC具有免疫侵襲性,這使其成為異基因移植的有利細胞類型。可降低排斥風險和移植并發癥。在利用自體間充質干細胞支持軟骨、半月板、肌腱、骨折等人體組織的健康愈合方面也取得了顯著進展。
√ 臨床安全性和有效性:MSC通過無創、無痛靜脈注射,大約2-3個小時內完成,確保最大程度的吸收和有效性。
√ 不成瘤:相比IPSC,幾乎不具備成瘤性。
√ 全球合規性和質量保證:治療過程符合美國食品及藥物管理局(FDA)的規定和GMP準則,彰顯其高度的安全性和質量標準。
MSC來源:
MSC應用較為廣泛的3類來源為:
臍帶來源間充質干細胞UC-MSC

脂肪來源間充質干細胞ADSC

骨髓來源間充質干細胞BM-MSC

其中臍帶來源的UC-MSC具有增殖能力、分化能力強等優點,并且其取材不涉及倫理問題,臨床應用最為廣泛。
三者不同見下表:
表1. 應用較為廣泛的3類來源MSC特點
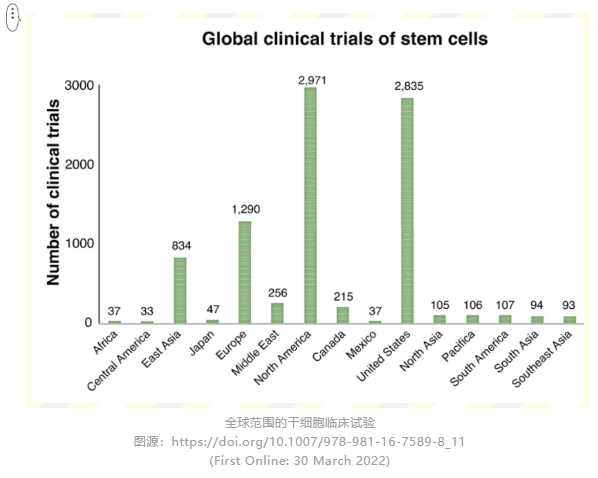
02、間充質干細胞的臨床試驗呈指數級增長,近年來我們在哪里?
各國監管:
目前,美國,歐盟,韓國,將干細胞療法歸入藥物范疇進行管理,已有干細胞藥物批準;
日本雙軌制:醫療技術(厚生勞動省)和新藥申報(藥品與醫療器械局),已有醫療機構收費開展,也已有干細胞藥物批準;
中國:干細胞按藥品、第三類醫療技術管理的“雙軌制”監管。醫藥企業的干細胞制劑鼓勵按藥品申報,由國家食品藥品監督管理總局(NMPA)監管;醫療機構主導的干細胞生物醫學新技術,按醫療技術進行管理,由衛健委監管。目前無醫療機構收費開展,也無干細胞藥物批準。
目前MSC細胞治療藥物獲批情況:
全球經批準的細胞治療產品共34款,包括22種干細胞(間充質干細胞10種),12種免疫細胞。其中,美國首個間充質干細胞產品remestemcel-L,治療類固醇難治性急性移植物抗宿主疾病(SR-aGVHD),兒童患者的生物制品上市許可申請(BLA)2024有望通過。
免疫細胞治療產品12種:
FDA批準上市6款CAR-T,中國NMPA批準上市2款CAR-T,韓國KFDA批準上市1款CIK;
 全球獲批免疫細胞治療產品(火石數鏈)
全球獲批免疫細胞治療產品(火石數鏈)間充質干細胞(MSCs)產品12種:
適應癥主要分為兩大類:組織修復和免疫調節;迄今為止美國FDA未批準任何一款間充質干細胞產品上市。
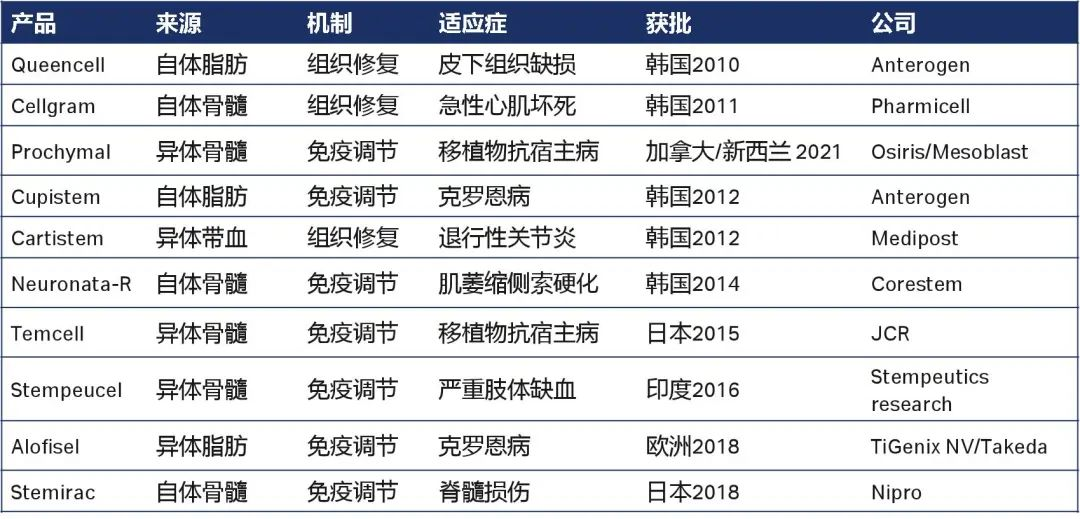 全球獲批間充質干細胞(MSCs)治療產品(火石數鏈)
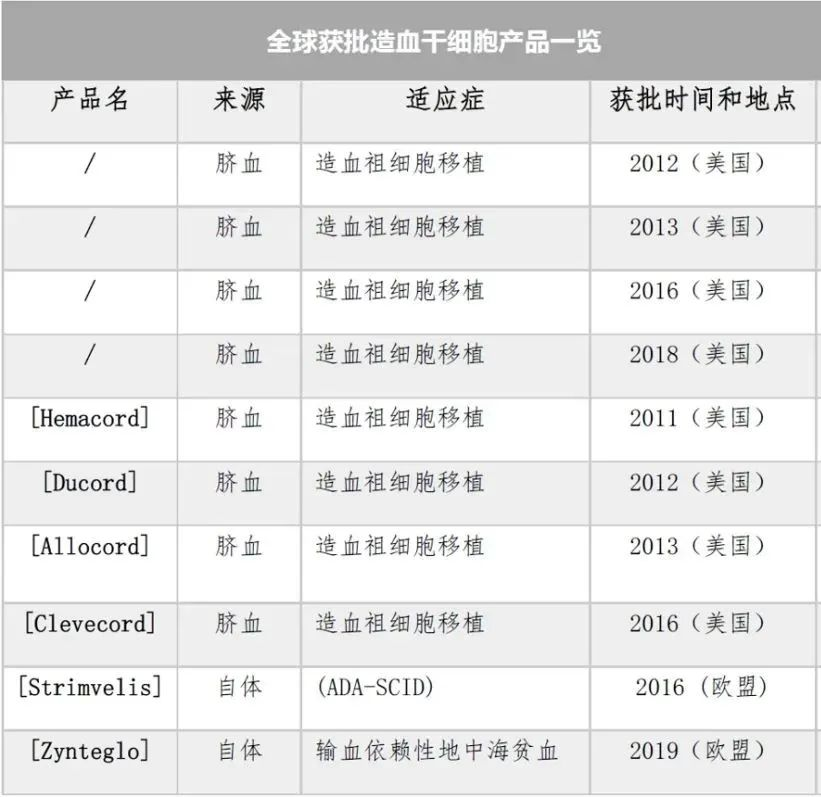
全球獲批間充質干細胞(MSCs)治療產品(火石數鏈)造血干細胞(HSC)產品10種:
目前全球批準的造血干細胞療法共有10種。FDA批準8種臍血產品,均用于造血干細胞移植的治療;
03、間充質干細胞MSC大規模貼壁培養解決方案
將組織細胞從供者體內獲取后通過相關技術手段制成成品細胞輸入到患者體內的一系列操作便是MSC產品的生產過程,該過程可分為上游工藝(供著細胞采集、早期小規模體外培養、大規模細胞擴增)和下游工藝(收獲、分離、清洗、濃縮、制劑罐裝、凍存等)。
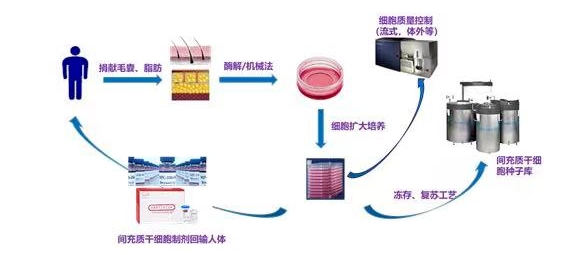

MSC工藝開發和生產全過程(Cityva思拓凡)
下面分享Genever在MSC大規模貼壁培養的解決方案。
3.1 細胞工廠大規模貼壁培養
間充質干細胞治療方式一般分為自體治療和異體治療,自體治療優勢是避免了倫理問題,無需考慮免疫排斥,但供體的質量難以把控,同時生產成本也較高。自體治療生產時一般采用細胞工廠進行貼壁生長,每平方厘米差不多可以收獲5萬個細胞左右,若按照回輸量為108cells,就需要細胞工廠的面積至少為2000cm2(至少一個4層的細胞工廠,還要考慮用來質量檢測的細胞,實際需要更多)。
細胞工廠的采用,相對于T瓶,可以很大程度的節省空間。同時,從T瓶到細胞工廠的放大,可以直接線性擴增,在放大原理上相對簡單。
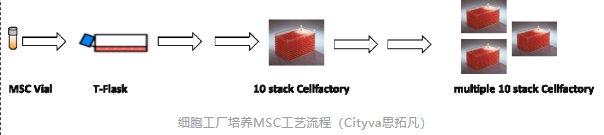
將MSC細胞復蘇到T175后,第二代擴增到多個T175中,第三代即可擴增到10層細胞工廠中。每代接種密度為7000-10000 cells/cm2,經過6代擴增,最終擴增到6個 10層細胞工廠。
3.2 法規文件鼓勵干細胞臨床研究封閉化,我們可以給出的方案
干細胞產品在我國進行雙軌制監管(藥品、技術管理)。為規范并促進我國干細胞臨床研究,國家衛生計生委與食品藥品監管總局共同組織制定了《干細胞臨床研究管理辦法(試行)》,該文件是首個針對干細胞臨床研究的管理指導文件,對干細胞研究機構以及項目立項備案等方面進行了規定,使中國干細胞臨床研究的發展有循可依;之后又根據此文件制定了《干細胞制劑質量控制及臨床前研究指導原則(試行)》,于2015年發布。

細胞治療產品生產質量管理指南(CDE)

產品特點
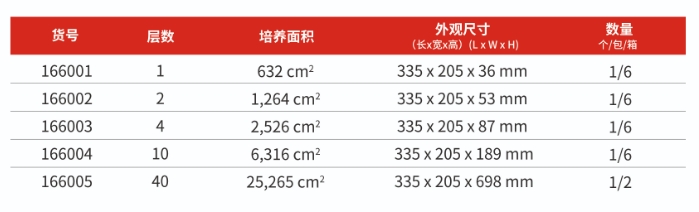
● 基于10層,40層細胞工廠定制;
● 進出液管路可選CPC連接器或者TPE焊接管路;
●使用經過驗證的耐輻照碟式通氣濾器。
3.3
法規文件規定干細胞治療物料來
源保證其來源合法,安全且符合
質量標準,我們可以給出的方案
Genever細胞工廠驗證指南包含組件列表,測試信息,產品驗證信息,工藝鑒定,質量控制,驗證和監管信息

在細胞工廠的使用方面還有哪些問題呢?
在評論區留言,我們將一一答疑解惑哦~